Is het i.p.v. B12-tekort misschien
Methylene-THF-Reductase deficiëntie?


| Door Paula Bailly | Najaar 2013 |
|
De onderzoekers die constateerden dat er meer kinderen met de C667T-mutatie worden geboren sinds de Folic Acid Fortifation hebben zich afgevraagd hoe dit zou kunnen komen. Ze veronderstellen dat een hoop kinderen met deze mutatie, die wellicht normaal tijdens de zwangerschap al zouden zijn overleden, nu dankzij een verhoogd Foliumzuur niveau van hun moeder wèl geboren worden. Er is nog een andere aanwijzing dat dit het geval zou kunnen zijn. Vrouwen met MTHFR deficiency blijken vaker dan gemiddeld miskramen te hebben. In de USA worden vrouwen die miskramen kregen daar nu ook op getest, zodat ze bij een volgende zwangerschap de juiste begeleiding kunnen krijgen. Er zou wellicht ook nog een evolutionair voordeel kunnen zijn. Als er veel Foliumzuur beschikbaar is, dan is de bevolking goed doorvoed. Er is dan immers voldoende verse groente en fruit voorhanden. En juist dan wordt de C677T mutatie, leidend tot Methylene-THF-Reductase deficiency, vaker doorgegeven! Waarom zou het in evolutionair opzicht juist een voordeel kunnen zijn om als maatschappij in tijden van voorspoed wat meer individuen te hebben met een laag methyl-THF niveau in hun hersenen? Men weet inmiddels dat mensen met Autisme-Spectrum-Stoornissen minder
methyl-THF in hun hersenen hebben. Ook is het aantal Glutamate-receptoren
in de hersenen hoger waardoor ze vaak intelligenter zijn, maar ook hoog-sensitief.
Deze mensen zijn weliswaar wat minder goed in de dagelijkse dingen,
maar in een situatie van voorspoed kan een sameleving dat leien en
kunnen zij vrijgespeeld worden voor andere dingen.
|
Miskramen
MTHFR deficiency kan leiden tot miskramen. Dit geldt vooral voor de C677T variant. Hoe dit precies veroozaakt wordt weet men niet. Men vermoedt dat door een verhoogd Homocyste´ne gehalte van het bloed er stolsels in de bloedvaten van de placenta kunnen ontstaan. Ook kan dit leiden tot verhoogde bloeddruk (zwangeschaps-vergiftiging). | |
|
Mediterraan dieet
Nu we weten dat de C677T mutatie makkelijker overerft onder invloed van
Foliumzuur zou dat ook kunnen verklaren waarom de C677T mutatie
bij de Mediterrane bevolkings Het mediterraan dieet bestaat voor een zeer groot deel uit fruit en verse groenten, de groenten zowel gekookt als salades klaargemaakt. Vlees, vis en koolhydraten wordt in kleinere hoeveelheden gegeten. Daarmee zijn de hoeveelheden Foliumzuur die men via voeding binnen krijgt relatief hoog ten opzichte van de andere volken. |
|
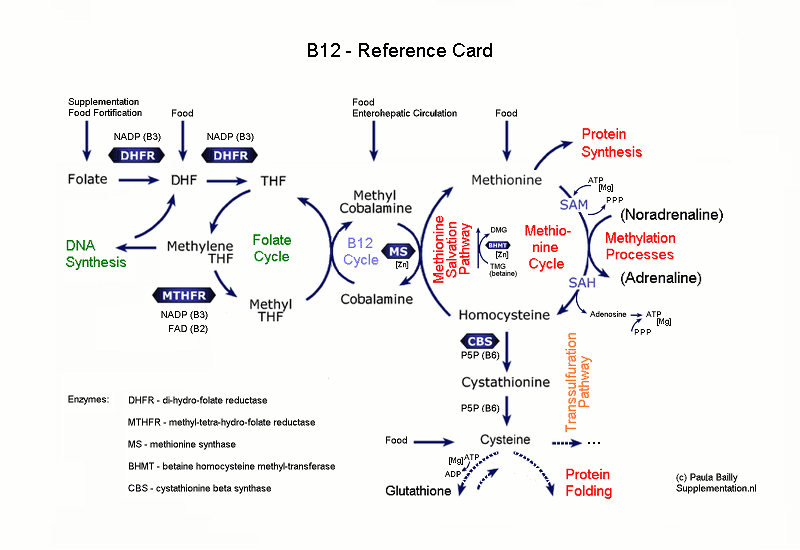
De van nature voorkomende varianten van Folate, Di-Hydro-Folate (DHF) of Tetra-Hydro-Folate (THF), zijn vrij instabiele verbindingen, wat ze ongeschikt maakt om in voedingsmiddelen of supplementen te verwerken. Chemisch Foliumzuur is veel stabieler. Vandaar dat dit de vorm is die gebruikt wordt als supplement, en voor de Food Fortification. Wat gebeurt er eigenlijk als we chemisch Foliumzuur toevoegen aan ons lichaam? Normaal zit in voeding Di-Hydro-Folate (DHF). Het enzym dat hiervoor nodig is, DHFR (Di-Hydro-Folate Reductase), heeft de eigenschap dat het de reactie nogal langzaam laat verlopen. De omzetting van DHF naar THF verloopt dus vrij traag.  Het enzym DHFR wordt ook gebruikt voor de omzetting van chemisch Foliumzuur naar DHF. (Eigenlijk hebben we geluk dat dit enzym deze taak óók op zich wil nemen, anders hadden we deze truc met chemisch Foliumzuur als supplement helemaal niet kunnen gebruiken!) Maar helaas verloopt deze omzetting naar DHF zelfs nòg trager dan de omzetting DHF -> THF. Dit heeft tot gevolg dat het lang duurt voordat chemisch Foliumzuur door ons lichaam wordt opgenomen. Temeer daar ons lichaam niet alleen druk is met omzetten van DHF uit voeding. Er is ook nog een cyclus gaande die weer DHF oplevert: Methylene-THF wordt in een proces voor DNA-synthese terug omgezet in DHF. En die lading DHF moet óók weer omgezet worden in THF. Het enzym DHFR heeft dus veel te doen, maar werkt langzaam. Dit heeft tot gevolg dat bij Foliumzuur suppletie er soms heel veel onverwerkt chemisch Foliumzuur in het lichaam rondzweeft. Maar dat dus in zijn chemische vorm onbruikbaar is. Het lichaam probeert dit tegen te gaan door in de darmen de opname van Folaten uit de voeding te verminderen. Desondanks blijken sommige mensen toch nog Foliumzuur-niveaus te hebben die tot ver boven de als maximum gestelde norm gaan. Onverwerkt Foliumzuur onstaat niet alleen door overmatige suppletie. Wanneer de verwerking van Foliumzuur in de biochemische pathways een obstructie tegenkomt, bijvoorbeeld doordat het enzym MTHFR (Methylene-THF-Reductase) niet goed werkt, dan kan er hierdoor ook een teveel aan onverwerkt Foliumzuur ontstaan. Hiermee is overmatige suppletie met Foliumzuur dus extra schadelijk voor mensen met MTHFR deficiency. |
HSP
Er is de afgelopen twee decennia steeds meer aandacht gekomen voor hypergevoeligheid. Blijkbaar kunnen niet-autistische mensen ook hypergevoelig zijn. In 1996 heeft Elaine Aron het begrip 'Hoog Sensitief Persoon' (HSP) geïntroduceerd, in het boek "Hoog Sensitieve Personen; Hoe blijf je overeind wanneer de wereld je overweldigt." In haar boek beschrijft zij uitgebreid hoe het voelt om hoogsensitieve zenuwen te hebben (zonder daar overigens mogelijke fysiologische oorzaken voor aan te dragen). Voor veel mensen was dit de herkenning, en èrkenning, die ze lang hadden gemist. Zoals voor Daphne Deckers. Zij schrijft: "Ik bèn geen kleinzerige bangerik; ik ben een 'Hoog Sensitief Persoon'. Kijk, daar kun je mee aankomen." Elain N. Aron publiceerde haar boek in 1996. Hoewel Folic Acid Fortification in de USA pas verplicht werd in 1998, werd er een aantal jaren daarvoor al aan heel wat voedingsmiddelen foliumzuur toegevoegd. Poly-Glutamate Ook natuurlijk Foliumzuur kan de Glutamate-belasting doen toenemen. De in de natuur voorkomende vormen van Folate zijn vaak Poly-Glutamaten. Dat wil zeggen: ze bevatten meer dan één Glutamate-groep. Folate kan echter maar met één Glutamate-groep opgenomen worden door de darmen. De andere Glutamate-groepen moeten dus eerst afgekoppeld worden. Dit vrije Glutamate kan dan apart door de darmen opgenomen worden. |
|
Hoe erg is het eigenlijk om veel onverwerkt chemisch Foliumzuur in het lichaam te hebben? De chemische naam van Foliumzuur is "Pteroyl-Mono-Glutamic Acid". 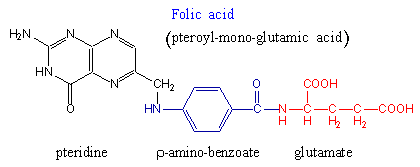 Zoals je op het plaatje hierboven kunt zien bestaat Pteroyl-Mono-Glutamic Acid (Foliumzuur) uit drie stukjes: Pteridine, P-Amino-Benzoaat en Glutamate. Voor ons is het belangrijk wat nader in te gaan op dit laatste stukje: de Glutamate. Hoewel Foliumzuur als B-vitamine ook wateroplosbaar is, wordt het teveel aan Foliumzuur in het lichaam niet allemaal zomaar weer uitgescheiden met de urine. Het lichaam kan een teveel aan Foliumzuur afbreken in de drie stukjes waaruit het is opgebouwd. Daarmee komt er dus extra Glutamate vrij. GlutamateGlutamate (Ned.: Glutamaat) werkt in de hersenen en in de perifere zenuwen als neurotransmitter. Het heeft als taak zenuwen te activeren (excitory). Vanwege de prikkelende functie op de zenuwen is het niet de bedoeling dat Glutamate zomaar los in het lichaam voorkomt. Het lichaam zelf gaat hier zeer omzichtig mee om en zorgt ervoor dat Glutamate normaal gesproken binnen de zenuwcellen opgeslagen blijft. Alleen als het als prikkel moet fungeren wordt het Glutamate uit de cel in de synaptische spleet gestoten. Om opgevangen te worden door de Glutamate-receptoren van de volgende zenuwcel, die daardoor dan geprikkeld wordt. Na z'n prikkelfunctie volbracht te hebben wordt het Glutamate vanuit de ontvangende zenuwcel getransporteerd naar een cel met ondersteunende functie. Deze cellen, de glial cells, zetten Glutamate om in onschadelijk Glutamine. Dit Glutamine kan dan rustig buiten de cellen vervoerd worden en een eindje verderop weer opgenomen worden. En dan kan het, nadat het eerst weer terug is omgezet in Glutamate, hergebruikt worden voor een nieuwe prikkeloverdracht. Glutamate wordt een "excito-toxin" genoemd. Het heeft een toxische (giftige) werking omdat een teveel aan Glutamate de zenuwen zo erg kan prikkelen dat dit zelfs uiteindelijk tot de dood van zenuwcellen kan leiden. Verder ondrukt Glutamate ook nog het afweersysteem. De hoeveelheid vrij Glutamate moet dus binnen de perken blijven. Helaas is niet alleen een te hoog Foliumzuurniveau verantwoordelijk voor de toename van vrij Glutamate. Ook diverse smaakstoffen en kunstmatige zoetstoffen worden in Glutamate omgezet. Verder leidt een te laag bloedsuikergehalte tot de productie van extra Glutamate. En ook andere lichaamsprocessen zoals ontstekingen of stress. Al met al kan de belasting van de zenuwen door Glutamate flink toenemen. Dit veroorzaakt hypersensitieve zenuwen, zowel in de hersenen als in de perifere zenuwen, waardoor men hypergevoelig wordt (zie kader: "HSP"). (Glutamate mag dan an sich de Blood Brain Barrier niet passeren, de verschillende vormen van Foliumzuur doen dat wel.) GABAGlutamate heeft een zenuwprikkelende functie. Er is een andere stof actief in de zenuwcellen die de overprikkeling tegen gaat met een kalmerend effect: Gamma-Amino-Butyric Acid (GABA, Gamma-Amino-Boterzuur). GABA wordt in de hersenen gesyntheseerd uit Glutamate. De omzetting van Glutamate naar GABA verloopt met het enzym GAD (Glutamic Acid Decarboxylase). Als cofactors heeft dit enzym (de juiste vorm van) vitamine B6 (Pyridoxal-5-Phosphate dus) en magnesium nodig. GABA en Glutamate horen met elkaar in balans te zijn. Als het lichaam onder een vorm van stress komt te staan (dat kan ook door een verwonding of ontsteking zijn), dan wordt de hoeveelheid Glutamate verhoogd. Daaropvolgend wordt in normale omstandigheden ook de hoeveelheid GABA verhoogd. Er wordt dan meer Glutamate omgezet in GABA. Als er echter een probleem is met de omzetting van Glutamate naar GABA, bijvoorbeeld door B6-tekort of Magnesium-tekort, dan duurt deze omzetting langer en raken Glutamate en GABA uit balans. Er is dan te weinig GABA om het prikkelende effect van het overschot aan Glutamate te dempen. Met als gevolg dat het excito-toxische effect van Glutamate optreedt, wat de zenuwen kan beschadigen.- Glutamate en AutismeMen vermoedt dat Glutamate een rol speelt bij het ontstaan van Autisme. Als tijdens de periode van het ontstaan van de hersenen
het Glutamate niveau in de hersenen om de één of andere reden
verhoogd is, dan zullen er in de hersenen
meer Glutamate-receptoren aangemaakt worden. Er zijn diverse vormen van autisme.
De verschillende vormen kunnen sterk variëren in IQ:
b.v. een IQ dat hoger is dan normaal (Asperger)
of een IQ juist veel lager dan normaal (Klassiek Autisme). Ook lijkt er qua soort intelligentie
een verschuiving naar de 'Bèta' kant te zijn.
Alle vormen van autisme kenmerken zich door een wat achterblijven van de
taalontwikkeling, ook die met een gewoon of verhoogd IQ. Genetisch testenDe wetenschap is nu zover dat van de meeste enzymen de meest voorkomende mutaties wel bekend zijn. Daar kan ook op getest worden. En, afhankelijk van wat daar uit komt, kan het voedingspatroon van de patiënt aangepast worden en kan hij/zij de op zijn/haar situatie aangepaste supplementen gaan nemen. (Er zijn in de USA al enkele instituten die deze testen uitvoeren en aan de hand daarvan aanbevelingen doen voor voeding en supplementen.) Dit is een totaal nieuwe benadering van zorg. Het is de bedoeling dat de chemische medicijnen van de pharmaceutische industrie pas in tweede instantie worden aangewend wanneer deze eerste benadering niet de gewenste resultaten blijkt op te leveren. Voor MTHFR deficiëntie wordt hier al mee geëxperimenteerd.
Omdat het in geval van MTHFR deficiëntie beter lijkt te zijn
om geen gewoon Foliumzuur te nemen
worden er diverse middelen genomen als alternatief: Het beste alternatief lijkt Folinic Acid te zijn.
Dit medicijn, waarvoor een recept nodig is,
wordt in het lichaam direct omgezet in Methyl-THF,
dus zonder gebruik te maken van het enzym MTHFR. Ook Methyl-THF zelf kan worden genomen als supplement. Dit heeft als nadeel dat het direct de blood-brain barrier kruist. En een verhoogd Methyl-THF niveau in de hersenen veroorzaakt bijwerkingen. Methyl-Cobalamine wordt genomen om op een directe manier de methylatie te versterken. |
Smaakversterkers en kunstmatige zoetstoffen
Omdat Glutamate de blood-brain barrier niet kan passeren gaat men er vanuit dat de invloed van Glutamate in voeding wel mee zal vallen. Glutamate heeft echter wel direct effect op de hypothalamus en de werking van de perifere zenuwen. Nancy Mullan MD raadt aan zo min mogelijk Glutamate via voeding te nemen en ook zo min mogelijk stoffen die door het lichaam in Glutamate worden omgezet. De smaakversterkers E621 t/m E625 bevatten Glutamate. Glutamate heeft een bepaalde smaak. Deze smaak wordt zelfs tegenwoordig als vijfde smaak erkent, naast zoet, zout, zuur en bitter. Deze vijfde smaak heeft ook een eigen naam: "Umami". Glutamine, populair als supplement omdat het goed is voor de darmen, kan in Glutamate worden omgezet. Ook smaakversterker E620 bevat Glutamine. Verder kunnen de zoetstoffen in de Aspartaat familie ook worden omgezet in Glutamate, zoals de bekende zoetstof "Nutrasweet". Hypoglycemie Na inname van suikerhoudende voeding of witmeel producten kan hypoglycemie ontstaan. Het lichaam maakt dan ineens veel insuline aan om de bloedsuikerpiek tegen te gaan. Wanneer er daardoor te weinig glucose de hersenen bereikt gaat het Glutamate-niveau in de hersenen oplopen. Het gerucht dat kinderen druk zouden worden van suiker kan wellicht aan dit mechanisme geweten worden. Het eten van eiwitrijk voedsel naast de suiker of koolhydraten kan hypoglycemie voorkomen of beperken. Demyelation Dat B12-tekort leidt tot demyelation van de zenuwen is wetenschappelijk aangetoond, o.a. door biopties. Men legt de oorzaak bij gebrek aan methylering. Het mechanisme achter deze demyelation is echter nog niet ontrafeld. Na de verhandeling over Glutamate begin ik me af te vragen of de demyelation wel de oorzaak is van de zenuwschade. Of misschien juist een gevolg?
Het zou wellicht zo kunnen zijn dat een teveel aan Glutamate de zenuwen beschadigd,
en dat als een zenuw uiteindelijk niet meer werkt,
demyelation ervan ook niet meer nodig is.
|
Naar Deel 4MTHFR deficiency ligt vaak ten grondslag aan het minder goed functioneren van het enzym MTHFR. Dit heeft vervolgens effect op de hoeveelheid actief B12 . Maar dit is beslist niet de enige factor die van invloed is. In Deel 4 wordt een overzicht gegeven van de andere factoren die een samenhang hebben met de werking het enzym MTHFR en de invloed ervan op de Methionine Salvation Pathway. |