|
Een wat laag B12-niveau kan in gewone omstandigheden
waarschijnlijk niet zo veel kwaad.
Dit wordt echter anders wanneer het lichaam ziek wordt.
Bij een infectieziekte wordt er in het lichaam een overmaat aan
Stikstof-Mono-Oxide (NO, Nitric Oxide) gevormd.
Het was al langer bekend dat lachgas (N2O, Di-Stikstof-Mono-Oxide of Nitrous Oxide)
B12-moleculen (Cobalamine) kan beschadigen.
Lachgas werd vroeger veel, en nu nog wel, gebruikt als narcosemiddel.
Omdat het lachgas de vrije B12-moleculen beschadigt hebben mensen met een laag B12-niveau
grote kans daar vervelende nawerkingen van te hebben.
Nu is bekend geworden dat ook het lichaamseigen NO
(Stikstof-Mono-Oxide of Nitric Oxide)
het vrij Cobalamine kan beschadigen.
En wel onder invloed van licht.
NO wordt door het lichaam aangemaakt door omzetting van het aminozuur Arginine.
NO bevordert de bloedsomloop doordat het een vaatverwijdend effect heeft.
Ook bevordert het de aanmaak van bepaalde immuuncellen.
NO wordt echter in grotere hoeveelheden door het lichaam geproduceerd
als er sprake is van infectie. Ook bij zoiets als whiplash wordt
veel meer NO geproduceerd (zogenoemde 'steriele infectie').
Sommige infecties zijn chronisch. Zoals bijvoorbeeld het geval is bij
infectie met een virus uit de Herpesfamilie; deze virussen blijven voor de rest
van het leven in het lichaam aanwezig. Meestal in slapende toestand,
maar als het lichaam, door bijvoorbeeld zoiets simpels als stress,
in een toestand van verminderde afweer komt, dan speelt zo'n virus vaak weer op.
Onze huid blijkt gedeeltelijk doorlaatbaar te zijn voor licht (translucent).
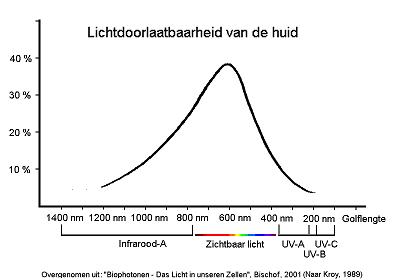
Van Infrarood licht en Ultraviolet licht wordt slechts 5% door de huid doorgelaten.
Maar van het gewone zichtbare licht wordt wel grofweg 1/3 deel doorgelaten.
En precies door deze doorgelaten lichtfrequenties van het zichtbare licht
wordt vrij Cobalamine het meest beschadigd!
Bij het beschadigen van Cobalamine door NO onder invloed van licht gaat het
om vrij Cobalamine dat niet gebonden is aan een methyl-groep of een adenosyl-groep.
Als door een laag methyl-THF niveau het Cobalamine lang moet wachten op een methylgroep
dan loopt het de kans beschadigd te raken door NO.
Dit beschadigde Cobalamine wordt door het lichaam afgevoerd met de urine.
Iedere keer dat een infectie oplaait gaat het lichaam dus B12 verbruiken.
Bij chronische infectie is het aan te raden om B12 te supplementeren,
om zo een uiteindelijke uitputting van de B12-voorraad te voorkomen.
MTHFR up- en downregulating factors
Na deze uitgebreide verhandelingen over Methylene-THF-Reductase deficiëntie
lijkt het een vaststaand gegeven hoeveel methyl-THF er in iemands lichaam beschikbaar komt.
Maar dat ligt wat genuanceerder:
De hoeveelheid van het enzym MTHFR (Methylene-THF-Reductase)
is niet altijd constant.
De werking van het enzym MTHFR (Methylene-THF-Reductase)
kan namelijk door het lichaam bijgeregeld worden.
Onder bepaalde omstandigheden gaat het lichaam meer
MTHFR aanmaken:
- Wanneer het Homocysteïne niveau verhoogd is
- Wanneer in de cellen de eiwitsynthese
niet helemaal goed verloopt (Unfolded Protein Response)
Òf het lichaam gaat juist minder MTHFR aanmaken:
- Wanneer er veel activiteit is van SAM (S-Adenosyl-Methionine)
Homocysteïne verhoogd
Homocysteïne is een schadelijke stof voor vooral de weefsels
waarin de cellen snel vernieuwen.
Het is logisch dat als het Homocysteïne niveau oploopt,
het lichaam constateert dat de normale afbraak route
(de Transsulfuration Pathway) het blijkbaar niet helemaal aan kan.
En dus gaat zoeken naar een andere weg om het Homocysteïne niveau
weer wat omlaag te krijgen.
Dat kan door het Homocysteïne maar wat meer te recyclen tot Methionine.
maar daarvoor is dan meer methyl nodig.
Door de hoeveelheid MTHFR te verhogen zorgt het lichaam ervoor
dat er meer methyl-THF aangemaakt kan worden,
om het methyl aan te kunnen leveren dat voor de
Homocysteïne recycling nodig is
in de Methionine Salvation Pathway.
Unfolded Protein Response
Methionine is ook nodig voor eiwit-synthese.
Veel van onze weefsels bestaan voor een groot deel uit eiwitten.
En ook enzymen worden voor een deel uit eiwitten opgebouwd.
Een eiwit bestaat uit aminozuren. Deze zitten aan elkaar
in een bepaalde volgorde, specifiek voor dat eiwit.
De recepten voor ieder eiwit liggen opgeslagen in ons DNA.
En ons DNA ligt ligt opgeslagen in de celkern.
Het maken van een eiwit begint bij het opensplijten van het DNA.
De dubbele spiraal rolt open en de de basen komen bloot te liggen.
De volgorde van de basen wordt gecopiëerd naar mRNA (messenger RNA).
Het mRNA gaat met het recept voor het bepaalde eiwit de celkern uit
om het een eindje verderop af te leveren bij het eiwitfabriekje in de cel.
In het Granulair Endoplasmatisch Reticulum zitten
fijne korreltjes, de Ribosomen, waarin de eiwitten vervolgens geproduceerd worden.
Ieder groepje van drie basen (triplet) codeert voor één van de
twintig aminozuren waaruit de eiwitten kunnen bestaan.
Ook voor de betekenis "einde" (van het recept) zijn er triplets.
Er is echter geen aparte code voor "begin", de code voor Methionine
wordt óók gebruikt om het begin van een recept aan te geven.
En omdat een recept dus altijd begint met "Methionine", moet er voldoende
Methionine aanwezig zijn om een eiwit te kunnen maken.
(Die begin-Methionine wordt dan later meestal weer van het eiwit
afgeknipt en hergebruikt.)
Eiwitten zijn zo lang dat ze opgevouwen
moeten worden om hanteerbaar te blijven.
Als dit mis gaat
(door bijvoorbeeld calcium-tekort)
dan reageert de cel hierop met een bepaalde stress-reactie:
de Unfolded Protein Response
Het lijkt daarom zinvol dat als de eiwitsynthese niet helemaal goed
gaat, het lichaam probeert dit proces te ondersteunen met de aanmaak van
meer Methionine. En dus met het stimuleren van de Methionine Salvation Pathway
door meer MTHFR aan te maken.
SAM activiteit
Wanneer er veel activiteit is van SAM (S-Adenosyl-Methionine) dan wordt
de activiteit van het enzym MTHFR verlaagd. Waardoor er dus minder
methyl-THF wordt aangemaakt. En daardoor kan er in de Methionine Salvation Pathway
minder Homocysteïne worden gerecycled tot Methionine.
Dit is dus een geval van tegenkoppeling: Als er méér
SAM gebruikt wordt, komt er juist mìnder Methionine beschikbaar
om omgezet te worden in SAM.
Dat lijkt op het eerste gezicht best een beetje onlogisch.
Een paar onderzoekers hebben onderzoek gedaan naar wat er gebeurt als
het lichaam een grotere lading Methionine (in voeding) te verwerken krijgt.
Het blijkt dat deze lading zo snel mogelijk wordt omgezet in SAM:
de hoeveelheid Methionine in het lichaam verhoogd nauwelijks,
maar de hoeveelheid SAM loopt flink op.
 De extra hoeveelheid SAM wordt dan gebruikt voor de verschillende methylatie-processen
en er ontstaat het afvalproduct Homocysteïne.
De extra hoeveelheid SAM wordt dan gebruikt voor de verschillende methylatie-processen
en er ontstaat het afvalproduct Homocysteïne.
Maar door de verhoogde activiteit van SAM wordt de activiteit van (tenminste)
drie enzymen beïnvloed.
De invloed van verhoogd SAM op:
- MTHFR
De activiteit van het enzym MTHFR (Methylene-THF-Reductase), dat
nodig is voor de Homocysteïne recycling tot Methionine, wordt verlaagd.
- BHMT
Ook de extra pathway voor de Homocysteïne recycling tot Methionine,
degene die in de lever plaats vindt, wordt beperkt.
Doordat de activiteit van het enzym voor deze pathway,
het BHMT enzym (Betaïne-Homocysteïne-Methyl-Transferase),
verlaagd wordt.
- CBS
De activiteit van de Transsulfuration Pathway wordt juist versterkt.
Dit gebeurt doordat de werking van het enzym CBS (Cystathionine-Beta-Synthase)
verhoogd wordt.
Na een grote Methionine-inname wordt er door deze veranderingen van enzym-werking
(twee beperkingen en één versterking) dus nog nauwelijks
Homocysteïne gerecycled tot Methionine.
Het afvalproduct Homocysteïne wordt nu zoveel mogelijk afgevoerd
via de Transsulfuration Pathway en verder verwerkt tot andere nuttige stoffen.
Dit mechanisme zou in de tijd van de jager/verzamelaars z'n nut kunnen hebben gehad.
Toen was er maar af en toe de beschikking over een grote hoeveelheid vlees
(dat veel Methionine bevat).
Vlees kun je niet lang bewaren en werd dus relatief snel opgemaakt. Waardoor
de mensen op sommige momenten vrij grote hoeveelheden Methionine te verstouwen kregen.
In plaats van het bijvoorbeeld op te slaan, probeert het lichaam deze extra hoeveelheid dus
zo snel mogelijk weg te werken.
De rest van de tijd kregen ze via het eten van noten en zaden genoeg
Methionine binnen, waardoor een
Methionine-voorraad in het lichaam ook helemaal niet nodig was.
| |
Post-Vaccinaal Syndroom
In zijn boekje "Vitamine B12-tekort" vertelt Hans Reijnen
(arts en B12-specialist) dat een aanzienlijk aantal van zijn patiënten
met B12-tekort ook last had van Post-Vaccinaal Syndroom.
Ten eerste worden bij vaccinaties virussen ingebracht. Deze
veroorzaken een toename van NO in het lichaam, waardoor vrije
B12-moleculen beschadigd kunnen raken. (Het zelfde effect als bij
Post-Viraal Syndroom.)
Vaak bevatten vaccinaties ook nog kwik. Kwik heeft een remmende werking
op het enzym MS (Methionine Synthase). Op deze manier wordt bij het
Post-Vaccinaal Syndroom de methylatie op twee manieren verstoord.
Zwanger en veel zonnebaden? Geen goede combi!
Voor vrouwen die zwanger willen worden is het heel belangrijk om voldoende
Foliumzuur in het lichaam te hebben i.v.m. kans op openrugsyndroom (door
de eerder genoemde problemen met DNA-synthese). Daarom wordt hun tegenwoordig
aangeraden om voorafgaand aan - en in de eerste weken van de zwangerschap
Foliumzuur supplementen te slikken.
Minstens zo belangrijk is wellicht
het voorkómen van Foliumzuur-tekort,
door bijvoorbeeld Alcohol te vermijden en te stoppen met de pil.
Dat ook veel zonlicht kan leiden
tot Foliumzuur-tekort werd ontdekt in Brazilië.
Extreem veel zonnebaden, op vakantie of op de zonnebank, zou
voor zwangere vrouwen dan ook afgeraden moeten worden!
Mechanisme
Het mechanisme hierachter is niet precies bekend.
Wel bekend is dat vrij B12 (cobalamine) beschadigd wordt (door NO) onder invloed van licht.
Wellicht is het mechanisme als volgt:
Beschadigd vrij B12 wordt uitgescheiden in de urine.
Het aanwezige methyl-THF kan z'n methylgroep niet voldoende kwijt ('Methyl Folate Trap'),
waardoor er niet genoeg THF terug komt om omgezet te worden in Methylene-THF
(o.a. belangrijk voor het voorkómen van geboorteafwijkingen).
HPU
Mensen met HPU hebben een tekort aan B6 en zink.
B6-tekort leidt er toe dat het enzym CBS (Cystathionine-Beta-Synthase) niet
goed werkt. Dit heeft invloed op de Tanssulfuration Pathway:
Homocysteïne kan niet goed afgevoerd worden en zal zich ophopen.
Door upregulation van het enzym MTHFR probeert het lichaam
dit tegen te gaan; dit brengt de recycling van Homocysteïne
wat meer op gang.
Helaas: de HPUer heeft ook een tekort aan zink.
En zink is nodig als co-factor voor de beide enzymen
die helpen bij de Homocysteïne recycling
(MS (Methionine-Synthase) en
BHMT (Betaïne-Homocysteïne-Methyl-Transferase)).
Daardoor zal de HPUer toch
een verhoogd Homocysteïne niveau hebben,
ondanks wellicht prima B12- en Foliumzuur-niveaus.
Eiwit synthese
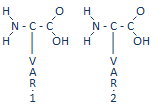
Eiwit wordt gevormd door een lange reeks van aminozuren.
De aminozuren kunnen als een soort van lego aan elkaar geklikt worden.
Een aminozuur bestaat uit twee vaste stukjes
(de klikdelen, voor ieder aminozuur het zelfde)
en een variabel stukje:
Het aan elkaar klikken van twee aminozuren gebeurt
onder afscheiding van H2O (water molecuul):
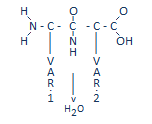
Op deze manier kunnen aminozuren bijna eindeloos aanelkaar
geklikt worden tot zeer lange ketens.
Dit heten polypeptide ketens.
Er zijn maar 20 verschillende aminozuren waaruit de
eiwitten opgebouwd worden. Iedere stof die uit eiwit bestaat
heeft zijn eigen volgorde van aanelkaar geklikte aminozuren.
Glutathione
Glutathione (Ned.: Glutathion)
is de belangrijkste antioxidant in ons lichaam.
Het beschermt ons tegen oxidatieve stress.
Ook helpt Glutathione de lever met het verwijderen
van schadelijke stoffen (ontgiften).
Glutathione wordt in de lever gesyntheseerd
uit Glutamate, Cysteïne en Glycine (waarbij Cysteïne
de rate-limiting factor is).
Van daar uit wordt het naar de rest van het lichaam getransporteerd.
Cysteïne ontstaat na afbraak van Homocysteïne,
in de Transsulfuration Pathway die plaats vindt in de lever.
Wanneer er te weinig Homocysteïne is (b.v. door een Methionine-tekort,
of doordat de Transsulfuration Pathway niet goed werkt) dan ontstaat er
te weinig Cysteïne. En daarmee ook te weinig Glutathione.
Glutathione is als supplement verkrijgbaar.
Protein Folding
Cysteïne is ook nodig om aangemaakte lange eiwitten op te vouwen.
Als er echter te weinig Cysteïne zou dreigen te zijn kan het lichaam
de benodigde Cysteïne weer vrij maken uit Glutathione.
Co-enzym A
Cysteïne maakt (samen met B5 (Pantotheenzuur) )
ook deel uit van Co-enzym A.
Co-enzym A is in de cellen nodig voor de verbranding van Glucose en vetten.
Cysteïne is een aminozuur
dat voorkomt in gewone eiwit-rijke voeding.
Cysteïne via voeding of supplement remt het enzym CBS,
zodat de Cysteïne-toevoer ongeveer constant zal blijven.
Als supplement is Cysteïne niet goed verdraagbaar;
het is dan beter om Cystine te nemen
(bestaande uit twee Cysteïne moleculen aan elkaar)
of Glutathione.
|

